《高考化學(xué)一輪復(fù)習(xí) 主題21 水的電離和溶液的酸堿性3含解析》由會(huì)員分享�,可在線閱讀,更多相關(guān)《高考化學(xué)一輪復(fù)習(xí) 主題21 水的電離和溶液的酸堿性3含解析(6頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索�����。
1����、
主題21:水的電離和溶液的酸堿性
李仕才
考點(diǎn)二 溶液的酸堿性與pH
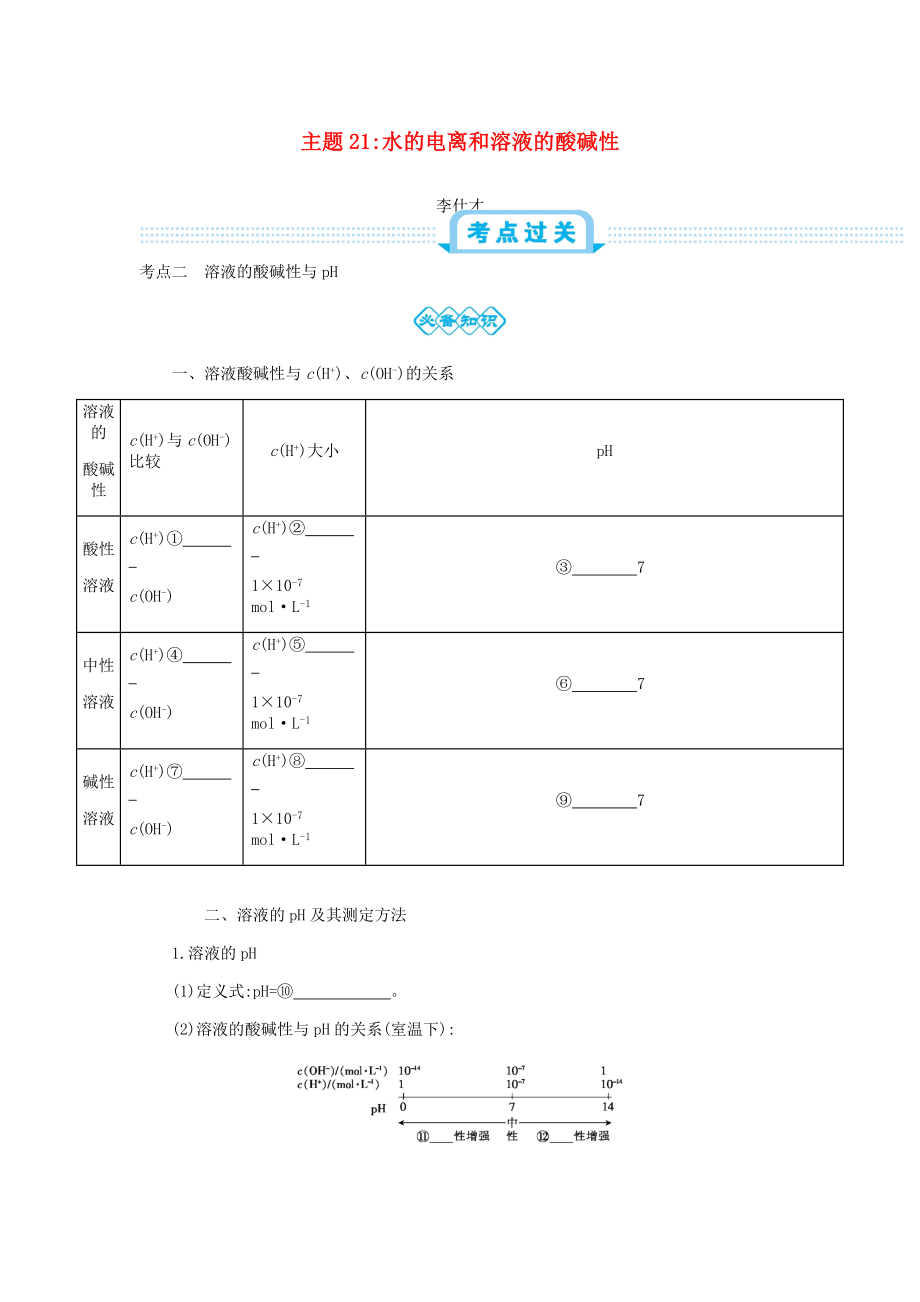
一��、溶液酸堿性與c(H+)�、c(OH-)的關(guān)系
溶液的
酸堿性
c(H+)與c(OH-) 比較
c(H+)大小
pH
酸性
溶液
c(H+)①
c(OH-)
c(H+)②
110-7 molL-1
③ 7
中性
溶液
c(H+)④
c(OH-)
c(H+)⑤
110-7 molL-1
⑥ 7
堿性
溶液
c(H+)⑦
c(OH-)
c(H+)⑧
110-7 molL-1
⑨ 7
二�、溶液的pH
2、及其測(cè)定方法
1.溶液的pH
(1)定義式:pH=⑩ �。
(2)溶液的酸堿性與pH的關(guān)系(室溫下):
2.pH的測(cè)定方法
(1)pH試紙測(cè)定
a.適用范圍:0~14
b.使用方法
把小片試紙放在 上,用 蘸取待測(cè)液點(diǎn)在干燥的pH試紙上,試紙變色后,與 對(duì)比即可確定溶液的pH。
c.注意事項(xiàng):pH試紙使用前不能用蒸餾水潤(rùn)濕,否則待測(cè)液被稀釋可能會(huì)產(chǎn)生誤差���。廣范pH試紙只能測(cè)出整數(shù)值����。
(2)pH計(jì)測(cè)定:可精確測(cè)定溶液的pH����。
三����、溶液pH的計(jì)算方法
1.總體原則
(1)若溶液為酸性,先求c(H+)?再求pH=-lgc(H+)。
(2
3��、)若溶液為堿性,先求c(OH-)?再求c(H+)=Kwc(OH-)?最后求pH���。
2.單一溶液的計(jì)算方法
(1)濃度為c的強(qiáng)酸(HnA):c(H+)=nc,pH=-lg nc���。
(2)濃度為c的強(qiáng)堿[B(OH)n]:由c(OH-)=nc可推c(H+)=10-14nc?再求pH=-lgc(H+)=14+lgnc����。
3.混合溶液的計(jì)算方法
(1)同性混合
若為酸的溶液混合,則先求c(H+)混=c(H+)1V1+c(H+)2V2V1+V2?再求pH����。
若為堿的溶液混合,則先求c(OH-)混=
c(OH-)1V1+c(OH-)2V2V1+V2?再求c(H+)=?最后求pH。
(2)異
4���、性混合
若酸過量,則先求c(H+)過=?再求pH���。
若堿過量,則先求c(OH-)過=?再求c(H+)=?最后求pH。
【答案】①>?���、? ③?����、?lg c(H+) 酸 堿 表面皿 玻璃棒 標(biāo)準(zhǔn)比色卡
1.室溫時(shí),下列混合溶液的pH一定小于7的是( )����。
A.pH=3的醋酸溶液和pH=11的氫氧化鋇溶液等體積混合
B.pH=3的鹽酸和pH=11的氫氧化鈉溶液等體積混合
C.pH=3的鹽酸和pH=11的氨水等體積混合
D.pH=3的硫酸和pH=11的氨水等體積混合
【解析】A項(xiàng),pH=3的醋酸溶液中c(H+)=110-3 molL-
5、1,pH=11的Ba(OH)2溶液中c(OH-)=110-3 molL-1,由于醋酸為弱酸,則醋酸過量,在室溫下等體積混合后,pH<7,正確;B項(xiàng),pH=3的鹽酸中c(H+)=110-3 molL-1,pH=11的NaOH溶液中c(OH-)=110-3 molL-1,酸���、堿都是強(qiáng)電解質(zhì),在室溫下等體積混合后,pH=7,錯(cuò)誤;C項(xiàng),pH=3的鹽酸中c(H+)=110-3 molL-1,pH=11的氨水中c(OH-)=110-3 molL-1,由于NH3H2O為弱堿,則堿過量,在室溫下等體積混合后,pH>7,錯(cuò)誤;D項(xiàng),pH=3的硫酸中c(H+)=110-3 molL-1,pH=11的氨水中c(O
6����、H-)=110-3 molL-1,由于NH3H2O為弱堿,則堿過量,在室溫下等體積混合后,pH>7,錯(cuò)誤����。
【答案】A
2.已知溫度為T時(shí)水的離子積常數(shù)為Kw,該溫度下,將濃度為a molL-1的一元酸HA與b molL-1的一元堿BOH等體積混合��。可判定該溶液呈中性的依據(jù)是( )���。
A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)=Kw molL-1
D.混合溶液中,c(H+)+c(B-)=c(OH-)+c(A-)
【解析】A項(xiàng),因酸堿的強(qiáng)弱未知,a=b只能說明酸與堿恰好完全反應(yīng),但若為強(qiáng)酸弱堿鹽或強(qiáng)堿弱酸鹽,則溶液不呈中性,錯(cuò)誤;B項(xiàng),因溫度未知,則pH=7時(shí)
7��、溶液不一定為中性,錯(cuò)誤;C項(xiàng),混合溶液中,c(H+)=Kw molL-1,根據(jù)c(H+)c(OH-)=Kw可知,溶液中c(H+)=c(OH-)=Kw molL-1,溶液呈中性,正確;D項(xiàng),任何溶液都存在電荷守恒,c(H+)+c(B-)=c(OH-)+c(A-),但不能由此確定溶液的酸堿性,錯(cuò)誤�。
【答案】C
3.常溫下,若使pH=3的鹽酸與pH=9的Ba(OH)2溶液混合使其成為pH=7的溶液,混合時(shí)鹽酸和Ba(OH)2溶液的體積之比為( )��。
A.1∶60 B.3∶1
C.1∶100 D.100∶1
【解析】常溫下,pH=3的鹽酸中c(H+)=110-3 molL
8����、-1,pH=9的Ba(OH)2溶液中c(OH-)=110-5 molL-1,兩溶液混合后溶液的pH=7,則n(H+)=n(OH-),設(shè)鹽酸體積為x L,Ba(OH)2溶液體積為y L,110-3 molL-1x L=110-5 molL-1y L,解得x∶y=1∶100,即鹽酸與Ba(OH)2溶液的體積之比為1∶100。
【答案】C
4.將pH=1的鹽酸平均分成兩份,一份加入適量水,另一份加入適量與該鹽酸物質(zhì)的量濃度相同的NaOH溶液,pH都升高了1,則加入的水與NaOH溶液的體積之比為( )�。
A.9 B.10 C.11 D.12
【解析】將pH=1的鹽酸平均分成兩份,
9、一份加入適量水,pH升高了1,說明所加的水是原溶液的9倍;另一份加入適量與該鹽酸物質(zhì)的量濃度相同的NaOH溶液后,pH升高了1,則10-11-10-1x=10-2(1+x),解得x=911,則加入的水與NaOH溶液的體積之比為9∶911=11∶1����。
【答案】C
5.25 ℃時(shí),將體積為Va、pH=a的某一元強(qiáng)堿與體積為Vb��、pH=b的某二元強(qiáng)酸混合�����。
(1)若所得溶液的pH=11,且a=13,b=2,則Va∶Vb= ���。
(2)若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b是否可以等于4? (填“是”或“否”)��。
【解析】(1)混合后溶液的pH為11,說明堿過量,
10��、則10-3=10-1Va-10-2VbVa+Vb,可得VaVb=1∶9�。
(2)由pH=a,得c(H+)=10-a,c(OH-)=10-14+a,再由pH=b,得c(H+)=10-b,強(qiáng)酸強(qiáng)堿恰好中和時(shí),10-14+aVa=10-bVb,VaVb=1014-(a+b),由于Va>Vb,故a+b<14,又由于b=0.5a,可推知b<143,故b可以等于4。
【答案】(1)1∶9 (2)是
1.等濃度�、等體積的一元酸與一元堿混合溶液的酸堿性
中和反應(yīng)
混合溶液的酸堿性
強(qiáng)酸與強(qiáng)堿
中性
強(qiáng)酸與弱堿
酸性
弱酸與強(qiáng)堿
堿性
簡(jiǎn)記為誰強(qiáng)顯誰性,同強(qiáng)顯中性
2.室溫
11、下,已知酸和堿的pH之和的溶液,等體積混合后溶液的酸堿性
(1)兩強(qiáng)混合
①若pH之和等于14,則混合后溶液顯中性,pH=7��。
②若pH之和大于14,則混合后溶液顯堿性,pH>7���。
③若pH之和小于14,則混合后溶液顯酸性,pH<7�����。
(2)一強(qiáng)一弱混合
pH之和等于14時(shí),一元強(qiáng)酸和一元弱堿等體積混合呈堿性;一元弱酸和一元強(qiáng)堿等體積混合呈酸性����。簡(jiǎn)記為誰弱顯誰性�。
3.溶液pH計(jì)算的一般思維模型
6EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F375
 高考化學(xué)一輪復(fù)習(xí) 主題21 水的電離和溶液的酸堿性3含解析
高考化學(xué)一輪復(fù)習(xí) 主題21 水的電離和溶液的酸堿性3含解析